Kredit: Zeitschrift für Hepatologie (2024). DOI: 10.1016/j.jhep.2024.05.017
Eine von klinischen Wissenschaftlern und Forschern des National Cancer Centre Singapore (NCCS) und des Genome Institute of Singapore (GIS) von A*STAR geleitete Studie hat eine unerwartete molekulare Heterogenität sogar innerhalb derselben Lebertumoren entdeckt.
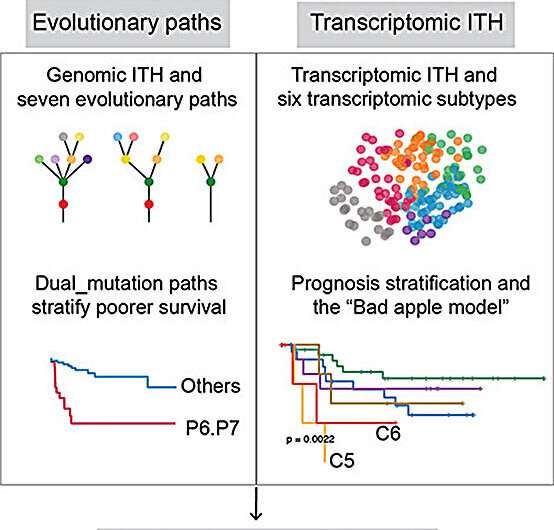
Mehr als 40 % der Fälle von Leberzellkarzinom (HCC) weisen mehr als einen molekularen Subtyp innerhalb desselben Tumors auf. In diesen Fällen lässt sich der klinische Ausgang für die Patienten am besten anhand des aggressivsten Subtyps vorhersagen. Dieses Phänomen, das als „Bad Apple Effect“ bezeichnet wird, hat erhebliche Auswirkungen auf das Verständnis von Leberkrebs und legt nahe, dass eine ganzheitlichere Stichprobennahme von Leberkrebstumoren erforderlich ist, um die Untersuchung und Behandlung der Krankheit zu verbessern und so die Ergebnisse für die Patienten zu optimieren.
Diese neuen Erkenntnisse sind veröffentlicht im Zeitschrift für Hepatologie.
In Singapur ist Leberkrebs die dritthäufigste Krebstodesursache bei Männern und die fünfthäufigste bei Frauen. HCC, die häufigste Form von primärem Leberkrebs, ist der einzige häufige solide Organkrebs ohne validierte prädiktive Biomarker. Das bedeutet, dass Ärzte nicht in der Lage sind, anhand molekularer Biomarker zu bestimmen, welches Medikament für einen einzelnen Patienten mit HCC am besten geeignet ist. Dies ist einer der Gründe, warum die Behandlung im Vergleich zu anderen häufigen Krebsarten weniger wirksam ist. Die Letalitätsrate von HCC beträgt heute 0,92 – die höchste aller Krebsarten bei Asiaten.
Um diesen ungedeckten klinischen Bedarf zu decken und die Behandlung von HCC zu verbessern, wurden im Rahmen der PLANet-Studie (Precision Medicine in Liver Cancer across an Asia-Pacific Network) über 600 Tumor- und angrenzende normale Proben analysiert, die 123 HCC-Patienten aus Singapur, Malaysia, Thailand und den Philippinen operativ entnommen wurden. Die Proben wurden mithilfe eines multiregionalen Probenentnahmeverfahrens analysiert, das eine detaillierte Profilierung der genomischen und zellulären Heterogenität innerhalb jedes Tumors ermöglicht, um deren Einfluss auf den Krankheitsverlauf zu bewerten.
Das Team stellte fest, dass es eine unerwartete intratumorale Heterogenität im HCC-Transkriptom gibt, das auch als RNA-Transkript bekannt ist und das Verhalten von Tumorzellen bestimmt. Dies deutet darauf hin, dass die derzeitige Praxis, eine einzelne Probe von Leberkrebstumoren zu entnehmen, die Komplexität des Tumors erheblich unterrepräsentiert und ein umfassendes Verständnis des gesamten Tumorökosystems einschränkt. Diese Heterogenität könnte erklären, warum die Entwicklung von Therapeutika für HCC eine Herausforderung darstellt, da es nicht mit einem einheitlichen Ansatz behandelt werden kann.
Das zweite wichtige Ergebnis war, dass mehr als 40 % der analysierten HCC-Proben mehr als einen transkriptomischen Subtyp aufwiesen. Von diesen bestimmte der Subtyp mit der schlechteren Prognose den klinischen Verlauf und das Ergebnis jedes einzelnen Patienten. Dies ist das erste Mal, dass dieser „faule Apfel-Effekt“ bei HCC jemals nachgewiesen wurde. Das Team fand auch heraus, dass frühe und späte Tumorentwicklungsmerkmale wichtig für die Vorhersage des Überlebens der Patienten waren.
„Die Entdeckung des ‚Bad Apple Effect‘ bei der Entwicklung von Leberkrebs hat eine wichtige Blaupause für HCC hervorgebracht, die zur Verbesserung der Behandlung der Krankheit verwendet werden kann. Unsere Studie zeigt ein umfassendes Bild der Evolutionsgeschichte der Krankheit und ist eine wertvolle Quelle zum Verständnis der Tumorheterogenität und des klinischen Verlaufs“, sagte Professor Pierce Chow, Korrespondierender Hauptprüfer von PLANet 2.0, Hauptautor der Studie und leitender Chirurg in der Abteilung für Chirurgie und Chirurgische Onkologie am Singapore General Hospital und NCCS.
„Durch die Anwendung genomischer Technologien konnten wir eine hochauflösende Karte der verschiedenen Zelltypen erstellen, die im selben Tumor koexistieren. Jetzt können Kliniker die spezifischen Zellpopulationen bestimmen, die eine entscheidendere Rolle bei der Entstehung der Krankheit spielen, und therapeutische Ansätze entwickeln, um in Zukunft die aggressiveren Zellen anzugreifen“, sagte Associate Professor Tam Wai Leong, Theme PI von PLANet 2.0, Co-Seniorautor der Studie und stellvertretender Geschäftsführer von A*STARs GIS.
Zu der Gruppe gehören Mitarbeiter des A*STAR-Instituts für Molekular- und Zellbiologie und der Duke-NUS Medical School. Das Team hat seine Studien fortgesetzt, indem es in zwei therapeutischen Studien einen räumlichen Transkriptomik- und räumlichen Metabolomik-Ansatz verwendet hat, um die Mikroumgebung des HCC zu verstehen. Dieser Ansatz hat ergeben, dass die Kolokalisierung von Biomarkern für die Biologie des HCC wichtig ist und der Schlüssel zum Fortschritt bei der Entwicklung und Entdeckung neuer und wirksamerer Behandlungen für HCC sein wird.
Mehr Informationen:
Jianbin Chen et al., Ein multimodaler Atlas des hepatozellulären Karzinoms enthüllt konvergente Evolutionspfade und den „faulen Apfel“-Effekt auf die klinische Entwicklung, Zeitschrift für Hepatologie (2024). DOI: 10.1016/j.jhep.2024.05.017
Zitat: Studie deckt mehrere molekulare Untergruppen bei Leberkrebs auf, die die aggressivsten klinischen Ergebnisse bewirken (24. Juni 2024), abgerufen am 24. Juni 2024 von https://medicalxpress.com/news/2024-06-uncovers-multiple-molecular-subgroups-liver.html
Dieses Dokument unterliegt dem Urheberrecht. Außer für Zwecke des privaten Studiums oder der Forschung darf kein Teil davon ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich zu Informationszwecken.
