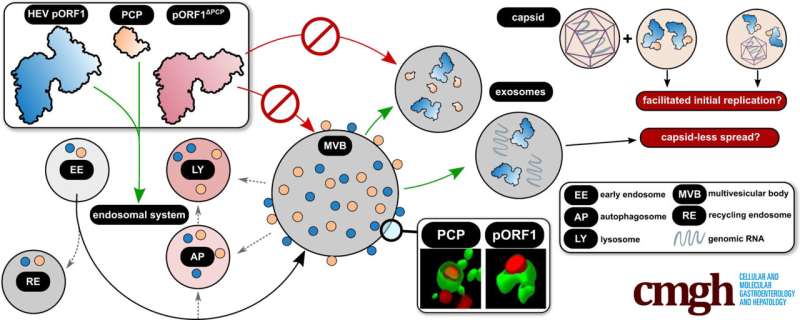
Grafische Zusammenfassung. Kredit: Zelluläre und molekulare Gastroenterologie und Hepatologie (2024). DOI: 10.1016/j.jcmgh.2024.01.001
Zu den häufigen Symptomen einer durch Hepatitis-E-Viren (HEV) verursachten Leberentzündung gehören Fieber, Bauchschmerzen, blasser Stuhl, Übelkeit und Gelbsucht. Zu den Risikopersonen für diese Infektion zählen Personen mit geschwächtem Immunsystem (immungeschwächt) sowie schwangere Frauen. Immungeschwächte Patienten leiden häufig an chronischen Infektionen, was für den globalen Norden ein größeres Problem darstellt.
Schwangere leiden häufig unter schweren Verläufen (fulminanter Hepatitis). Diese Art von Hepatitis ist mit Sterblichkeitsraten von bis zu 30 Prozent verbunden und kommt vor allem im globalen Süden vor. Die geografischen Unterschiede lassen sich dadurch erklären, dass zoonotische, lebensmittelübertragene HEV-Stämme (Genotypen 3 und 4) überwiegend im Norden zirkulieren, während im Süden die hauptsächlich über Wasser übertragenen Genotypen 1 und 2 vorkommen.
Bisher sind in Europa keine Impfstoffe gegen HEV zugelassen. Obwohl es Medikamente gibt, die zur Behandlung von Infektionen eingesetzt werden, sind die Behandlungsmöglichkeiten noch begrenzt und mit starken Nebenwirkungen oder Resistenzentwicklungen verbunden. Dies ist auch auf das mangelnde Verständnis großer Teile des viralen Lebenszyklus zurückzuführen.
Virales Polyprotein pORF1 – von zentraler Bedeutung für die Produktion des viralen Genoms und dennoch nahezu unbekannt
Die Reproduktion der genetischen Information des HEV (Genomreplikation) wird über das virale Polyprotein pORF1 vermittelt. Dieses Protein besteht aus mehreren Domänen. Eine Proteindomäne ist eine stabil gefaltete Struktur innerhalb eines Proteins, die funktionell und strukturell unabhängig von benachbarten Proteinsegmenten ist.
pORF1 ist das zentrale Protein für die Replikation (Replikase), das heißt, es ist für die Reproduktion der genetischen Information des Virus verantwortlich. Über pORF1 ist jedoch kaum etwas anderes bekannt, einschließlich seiner genauen Position in infizierten Zellen.
Forscher um Dr. Mirco Glitscher in der Arbeitsgruppe von Professor Eberhard Hildt, Leiter der Abteilung Virologie am Paul-Ehrlich-Institut, konzentrierten sich auf dieses wichtige unbekannte HEV-Element. In ihrer Forschung analysierten sie mithilfe der konfokalen Laser-Scanning-Mikroskopie die subzelluläre Lokalisierung von pORF1 und seinen einzelnen Domänen, die auf Basis einer Strukturvorhersage der viralen Replikase generiert und kloniert wurden.
Die aus den Zellen freigesetzten Exosomen wurden mittels Ultrazentrifugation isoliert und mittels isopyknischer (Trennung nach gleicher Dichte) Dichtegradientenzentrifugation analysiert. Anschließend wurden die abgetrennten Partikel mittels Fluorimetrie, Western-Blot-Analysen oder RT-qPCR genauer untersucht.
Das Vesikelsystem als Eckpfeiler der Virusvermehrung
Das Forschungsteam fand heraus, dass sich pORF1 im Vesikelsystem der Zelle – dem endosomalen System – und vor allem in multivesikulären Körpern (MVBs) anreichert. Diese Strukturen sind von zentraler Bedeutung für die Exosomenbildung und wurden bisher nur als Wirtsstruktur für die Freisetzung viraler HEV-Partikel angesehen. Es wurde festgestellt, dass das Vorhandensein der viralen Replikase hier von einer pORF1-Domäne, der PCP (Papain-ähnliche Cysteinprotease), abhängt.
So fand das Forscherteam heraus, dass die virale Replikase auch über Exosomen freigesetzt wird. Dieser Prozess wird durch die virale Protease vermittelt, die Teil der Replikase ist. Dadurch werden virale Genome über diesen Weg auch in Abwesenheit von Viruspartikeln freigesetzt.
Die Ergebnisse deuten darauf hin, dass pORF1 PCP-abhängig in MVBs eindringt und anschließend exosomal freigesetzt wird. Somit können die Freisetzung des Virus und die Replikation, die Reproduktion der genetischen Information, räumlich gekoppelt sein. Dies könnte die Ausbreitung einer Virusinfektion erleichtern, da Genome, die während einer erneuten Infektion in die Zelle gelangen, schnell auf exosomenübertragenes pORF1 treffen und repliziert werden können. Darüber hinaus deuten die gesammelten Daten darauf hin, dass das Kapsid nicht unbedingt für die Freisetzung von genetischem Material erforderlich ist.
Die Exosomen und die damit verbundenen Proteinstrukturen könnten geeignete Ziele für Therapeutika gegen HEV sein, da dadurch möglicherweise sowohl die Virusreplikation als auch die Virusfreisetzung verhindert werden könnten. Die Kapsid-unabhängige Freisetzung der HEV-Genome hat durchaus Auswirkungen auf die Diagnostik, da bislang davon ausgegangen wird, dass ein Zusammenhang zwischen der Menge an Viruspartikeln und viralen Genomen besteht.
Die Relevanz des Vorhandenseins genomischer RNA in Exosomen ohne Kapsid für diagnostische Verfahren muss jedoch noch untersucht werden.
Die Forschung wird in der Zeitschrift veröffentlicht Zelluläre und molekulare Gastroenterologie und Hepatologie.
Mehr Informationen:
Mirco Glitscher et al., Die Proteasedomäne in HEV pORF1 vermittelt die Lokalisierung der Replikase in multivesikulären Körpern und ihre exosomale Freisetzung, Zelluläre und molekulare Gastroenterologie und Hepatologie (2024). DOI: 10.1016/j.jcmgh.2024.01.001
Bereitgestellt vom Paul-Ehrlich-Institut
Zitat: Das Hepatitis-E-Virus: Neue Erkenntnisse zur gezielten Behandlung und Diagnose (2024, 16. Februar), abgerufen am 17. Februar 2024 von https://medicalxpress.com/news/2024-02-hepatitis-virus-insights-treatment-diagnosis.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von einem fairen Handel zum Zweck des privaten Studiums oder der Forschung darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.
